Ligação três centros dois elétrons
 Nota: Se procura a interação eletrostática popularmente chamada "ponte de hidrogênio", veja ligação de hidrogênio.
Nota: Se procura a interação eletrostática popularmente chamada "ponte de hidrogênio", veja ligação de hidrogênio.
Uma ligação três centros dois elétrons ou ligação tricentrada com dois elétrons (3c-2e) é uma ligação química em que um par de elétrons é compartilhado entre três átomos, diferentemente de uma ligação covalente convencional, na qual um par de elétrons é compartilhado entre dois átomos. Consequentemente, a ligação 3c-2e consiste em uma única ligação covalente unindo três átomos. [1] Esta ligação é frequentemente executada por átomos que possuem deficiência de elétrons, sendo que três átomos compartilham dois elétrons entre si. Quando um dos átomos envolvidos é um hidrogênio, ela também é conhecida por ponte de hidrogênio (no Brasil) ou hidrogénio (em Portugal), embora tal expressão também seja aplicada, em sentido menos técnico, às ligações de hidrogênio (que, no entanto, são um tipo de interação completamente diferente).
Descrição

Esse tipo de ligação é bem pouco comum na Natureza e ocorre geralmente em compostos covalentes nos quais alguns dos átomos são deficiente em elétrons, portanto, incapazes de completarem o octeto realizando ligações convencionais. As ligações 3c-2e são particularmente frequentes em compostos de boro (como os boranos), bem como alguns compostos covalentes de berílio, alumínio e alguns outros compostos covalentes de metais, além de certos carbocátions não-clássicos como o cátion 2-norbornil.
A combinação de três orbitais atômicos forma três orbitais moleculares: um ligante, um não-ligante e um antiligante. Os dois elétrons vão para o orbital ligante, resultando em um efeito de rede de ligação e constituindo uma ligação química entre os três átomos. Em muitas ligações comuns desse tipo, o orbital ligante é deslocado na direção de dois dos três átomos, em vez de ser igualmente distribuído entre os três. O exemplo mais simples de uma ligação 3c-2e é o hidrogênio protonado molecular, H3+.[2]. Isto resulta numa única ligação covalente unindo simultaneamente três átomos.
Representação

Diferentemente das ligações covalentes convencionais, que possuem formas padronizadas de representação (por exemplo, ligações simples, duplas, triplas ou mesmo coordenadas), as ligações 3c-2e não têm uma forma única e padronizada de serem escritas.[3] Isso frequentemente causa confusões ao se desenhar as estruturas moleculares e eletrônicas dos compostos que possuem esse tipo de ligação.
Uma forma frequente de representar essas ligações é por meio de traços como ocorre nas ligações covalentes comuns, porém geralmente a ligação tricentrada é representada como dois traços (como visto com frequência na representação do composto mais conhecido que realiza esse tipo de ligação, o diborano), levando, por vezes, à conclusão errônea de que esses traços tratam-se de duas ligações covalentes separadas em vez de uma única ligação, dando a entender que o átomo envolvido está formando mais ligações do que o seu octeto permite, o que não é o caso. [carece de fontes?]
Uma outra forma de representação muito utilizada é como linhas tracejadas,[4] mas isso também causa confusão pela ambiguidade, uma vez que linhas tracejadas também representam ligações fracas, híbridos de ressonância ou mesmo ligações parciais encontradas em complexos ativados.[5]


Contudo, há algumas propostas levantadas para escrever de uma forma mais coerente e inequívoca este tipo de ligação. Uma dessas formas consiste em escrever linhas ramificadas entre os três átomos envolvidos, embora isso às vezes possa ser confundido com as representações simplificadas de estruturas esqueléticas de moléculas orgânicas, onde átomos de carbono e hidrogênio são frequentemente omitidos. [carece de fontes?].

Há também outra abordagem que se utiliza de linhas curvas (por vezes referidas como “ligações banana”) para representar essa ligação, especialmente quando envolvem um átomo ou grupo pequeno (como o hidrogênio ou metil) em ponte entre dois grupos de átomos mais complexos.[6]

Outra forma consiste em representá-las como um traço unindo dois dos átomos envolvidos com uma seta (semelhante à representação de uma ligação coordenada) apontando do centro desse traço para o terceiro átomo[7]. Uma outra forma relacionada representa a ligação tricentrada como um traço entre o primeiro átomo envolvido e o segundo, e uma meia-seta partindo do segundo para o terceiro.[8]. Esta forma se diferencia de uma ligação coordenada (ou dativa), onde a seta representa um par de elétrons não-ligante doado de um átomo para outro, enquanto a meia-seta representa um par de elétrons ligante (ou seja, já envolvido em uma ligação) sendo compartilhado com o terceiro átomo.[9] No entanto, essas propostas ainda não foram oficializadas pela IUPAC.


Exemplos


Este tipo de ligação é vista em vários compostos de boro, como o diborano, B2H6; o monômero BH3 é instável já que o átomo de boro está perfazendo apenas seis elétrons de valência e, portanto, para formar um octeto estável compartilha elétrons com uma ligação B-H a outro átomo de boro, formando uma ligação B-H-B 3 centros dois elétrons. No diborano, há duas dessas ligações: dois átomos de hidrogênio realizam uma ponte entre os dois átomos de boro, deixando dois átomos de hidrogênio adicionais em ligações B-H ordinárias em cada átomo de boro. Este padrão de ligação é também visto no trimetilalumínio (Al(CH3)3), cuja estrutura real é um dímero (Al2(CH3)6), onde o átomo de carbono de um grupo metil realiza essa ponte.
O boro elementar também tem seus átomos ligados por ligações 3c-2e. Devido ao seu minúsculo tamanho, o átomo de boro é incapaz de ionizar-se para formar cátions B3+ e formar ligação metálica como os outros elementos do grupo 13 (como o alumínio). Como resultado, ele encontra-se deficiente de elétrons e recorre a formar ligações tricentradas para estabilizar-se. A maioria dos alótropos do elemento boro é constituído por unidades icosaédricas B12 ligadas entre si em padrões complexos, e tanto as ligações dentro de cada unidade icosaédrica quanto entre unidades adjacentes envolvem ligações tricentradas.[10]
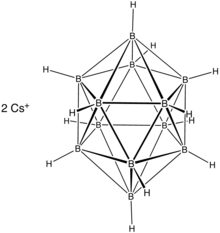
Nos boranos de estrutura mais complexa, podem existir tanto ligações tricentradas B-H-B quanto ligações B-B-B, formando estruturas semelhantes a gaiolas poliédricas. Nesses clusters, as ligações entre os boros são frequentemente híbridos de ressonância entre ligações covalentes convencionais B-B e ligações 3c-2e B-B-B. Algumas dessas estruturas, como o ânion em forma de gaiola icosaédrica B12H122- [11] e seus derivados, que possuem ligações 3c-2e (juntamente com ligações comuns) apenas entre os boros, são excepcionalmente estáveis devido ao híbrido de ressonância obedecer à regra de Hückel e, portanto, ser considerado um sistema aromático. [12]
Complexos organometálicos como o ferroceno ([Fe(C5H5)2]) e o Sal de Zeise K[PtCl3(C2H4)]•H2O, também contêm ligações 3c-2e em suas estruturas, resultantes da interação entre uma ligação dupla C=C (no caso, a ligação pi) e o átomo metálico.
Este tipo de ligação ocorre também em alguns compostos de carbono, onde é algumas vezes referida como hiperconjugação; outro nome para ligações três centros dois elétrons assimétricas.

Rearranjos de carbocátions ocorrem através da transição de estado de ligações três centros. Devido às estruturas das ligações três centros possuírem quase a mesma energia que os carbocátions, praticamente não há energia de ativação para esses rearranjos, o que faz com que eles ocorram a taxas extraordinariamente altas.
Várias espécies químicas chamadas de carbocátions não-clássicos possuem ligações três centros dois elétrons entre alguns de seus átomos. Talvez a estrutura desse tipo mais conhecida e estudada seja o cátion 2-norbornil.
Ver também
- Ligação três centros quatro elétrons
- Ligação de hidrogênio
- 9-Borabiciclo(3.3.1)nonano, ou "borano banana", um reagente orgânico.
- Interação agóstica
Referências
- ↑ ATKINS P. W., OVERTON, T.; ROURKE, J.; WELLER, M.; ARMSTRONG, F.A. Química Inorgânica. Porto Alegre: Bookman, 2017. p. 313. link.
- ↑ «IUPAC Gold Book» (PDF) (em inglês)
- ↑ https://www.covalentbondclass.org/wp-content/uploads/2020/02/CBC-and-3c-2e-bonds.pdf
- ↑ https://www.covalentbondclass.org/wp-content/uploads/2020/02/CBC-and-3c-2e-bonds.pdf
- ↑ https://www.pharmacy180.com/article/structure-of-the-activated-complex-1472/
- ↑ https://www.chem.ucla.edu/~cantrill/30A_F05/Diborane.pdf
- ↑ https://www.researchgate.net/figure/Classification-of-3-centre-2-electron-3c-2e-interactions-according-to-the-nature-of-the_fig25_232225251
- ↑ https://healy.create.stedwards.edu/Chemistry/MMedia/AdvOrganicProject/ParkinJChemEd.pdf
- ↑ https://pubs.acs.org/doi/abs/10.1021/acs.jchemed.9b00750
- ↑ https://www.researchgate.net/figure/The-structures-of-boron-allotropes-bulk-polymorphs-of-a-rhombohedral-boron-a_fig1_309657056
- ↑ Longuet-Higgins, Hugh Christopher; Roberts, M. de V. (June 1955). «The electronic structure of an icosahedron of boron atoms». Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences. 230 (1180): 110–119. Bibcode:1955RSPSA.230..110L. doi:10.1098/rspa.1955.0115 Verifique data em:
|data=(ajuda) - ↑ https://www.sciencedirect.com/science/article/abs/pii/016612809287074A











