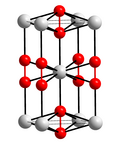
Nadtlenek baru
| |||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | BaO2 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 169,33 g/mol | ||||||||||||||||||||||||||||||||||||
| Wygląd | białoszare kryształy[1] | ||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||
| Numer CAS | 1304-29-6 | ||||||||||||||||||||||||||||||||||||
| PubChem | 14773 | ||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||||||||||||||
| Inne kationy | CaO | ||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Nadtlenek baru, BaO
2 – nieorganiczny związek chemiczny z grupy nadtlenków. Jest utleniaczem stosowanym m.in. do bielenia[2] i w pirotechnice[6].
Otrzymywanie
Nadtlenek baru może zostać otrzymany poprzez ogrzewanie tlenku baru w temperaturze 500 °C w powietrzu lub tlenie[2]:
- 2BaO + O
2 → 2BaO
2
Właściwości
Nadtlenek baru jest białoszarym ciałem stałym krystalizującym w układzie tetragonalnym. W temperaturze 700 °C rozkłada się do tlenku baru i tlenu. Rozkłada się także w niższych temperaturach, jednak znacznie wolniej. Z rozcieńczonymi kwasami tworzy nadtlenek wodoru[2]:
- BaO
2 + 2HCl → BaCl
2 + H
2O
2
Jest bardzo słabo rozpuszczalny w wodzie[7], w której rozkłada się powoli z wytworzeniem wodorotlenku baru[2].
Przypisy
- ↑ a b c d e f David R.D.R. Lide David R.D.R. (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-50, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b c d e f PradyotP. Patnaik PradyotP., Handbook of Inorganic Chemicals, McGraw-Hill, 2003, s. 90–91, ISBN 0-07-049439-8 .
- ↑ Barium peroxide, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2015-04-07] (ang.).
- ↑ a b c Barium peroxide, anhydrous (nr 769304) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2021-11-06]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Barium peroxide, anhydrous (nr 11428) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2012-06-22]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Barium peroxide [online], Hummel Croton [dostęp 2012-06-22] (ang.).
- ↑ Nadtlenek baru(II), międzynarodowa karta bezpieczeństwa chemicznego, Międzynarodowa Organizacja Pracy [dostęp 2012-06-22] (pol. • ang.).
- Britannica: science/barium-peroxide