Difosfano
| Difosfano | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Difosfano | |
| Nomi alternativi | |
| difosfina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | P2H4 |
| Massa molecolare (u) | 65,98 |
| Aspetto | liquido incolore |
| Numero CAS | 13445-50-6 |
| PubChem | 139283 |
| SMILES | PP |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,014[1] |
| Solubilità in acqua | 0,035 g/100ml a 0 °C |
| Temperatura di fusione | −99 °C (174 K)[1] |
| Temperatura di ebollizione | 63,5 °C (337 K) estrapolato[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 20,9 kJ/mol[2] |
| Indicazioni di sicurezza | |
| Modifica dati su Wikidata · Manuale | |
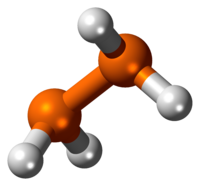
Il difosfano è il composto inorganico di formula P2H4. Questo idruro del fosforo in condizioni normali è un liquido incolore. Il difosfano è l'impurezza che di solito rende infiammabili campioni di fosfano (PH3). Nella vecchia nomenclatura questo composto era chiamato difosfina.
Storia
Il difosfano fu preparato per la prima volta da Paul Thénard nel 1844;[3] la sua composizione fu stabilita con certezza solo nel 1936.[4]
Proprietà fisiche
Il difosfano è un liquido incolore spontaneamente infiammabile a contatto con l'aria. È termicamente instabile al di sopra di –30 °C, e la sua decomposizione è accelerata in presenza di luce. A causa dei problemi di decomposizione non è possibile determinarne direttamente la temperatura di ebollizione, che è stata stimata estrapolando i dati di pressione di vapore. Il difosfano è leggermente solubile in acqua, mentre è molto solubile in vari solventi organici tra i quali benzene, toluene, n-esano, cicloesano, etere dietilico, solfuro di carbonio, piridina, triclorometano e tetraclorometano. Misure cristallografiche su polveri sembrano indicare che P2H4 cristallizzi nel sistema monoclino, con costanti di reticolo a = 360 pm, b = 660 pm, c = 520 pm e β = 104°, con due unità di formula per cella elementare. In fase liquida e gassosa la molecola di P2H4 adotta di preferenza una conformazione gauche, con distanze P–P di 221,9 pm e P–H di 145 pm.[2]
Sintesi
Il modo migliore per preparare il difosfano è la reazione di idrolisi a freddo del monofosfuro di calcio CaP:
- 2CaP + 4H2O → P2H4 + 2Ca(OH)2
Seguendo una procedura ottimizzata, l'idrolisi di 400 g di CaP con 400 ml di acqua a 20 Torr fornisce circa 20 g di difosfano, leggermente contaminato da fosfano.[2] Alternativamente si può far passare fosfano attraverso una scarica elettrica a 5-10 kV.[1]
Reattività
Il difosfano brucia spontaneamente con l'ossigeno dell'aria formando inizialmente pentossido di fosforo e acqua; il prodotto finale è acido fosforico. In presenza di acidi P2H4 dà una reazione di disproporzione e si formano PH3 e prodotti solidi più ricchi di fosforo con composizione varia. Con butillitio si ha pure disproporzione, con formazione di PH3 e prodotti polifosfurati come Li3P7.[2]
Note
Bibliografia
- (EN) M. Baudler e K. Glinka, Open-Chain Polyphosphorus Hydrides (Phosphanes), in Chem. Rev., vol. 94, n. 5, 1994, pp. 1273-1297, DOI:10.1021/cr00029a005.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) P. Royen e K. Hill, Über einige physikalische und chemische Eigenschaften des flüssigen Phosphorwasserstoffs. (Diphosphin P2H4), in Z. anorg. allg. Chem., vol. 229, n. 2, 1936, pp. 97-111, DOI:10.1002/zaac.19362290202.
- (FR) P. Thenard, Mémoire sur les combinaisons du phosphore avec l'hydrogène, in C. R. Acad. Sci. Paris, vol. 18, 1844, pp. 652-655.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su difosfano
Wikimedia Commons contiene immagini o altri file su difosfano
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia











