Kristalisasi

Kristalisasi atau penghabluran adalah proses pembentukan bahan padat dari pengendapan larutan, melt (campuran leleh), atau lebih jarang pengendapan langsung dari gas. Kristalisasi juga merupakan teknik pemisahan kimia antara bahan padat-cair, di mana terjadi perpindahan jisim (mass transfer) dari suatu zat terlarut (solute) dari cairan larutan ke fase kristal padat.
Termodinamika
Karakter proses kristalisasi ditentukan oleh termodinamika dan faktor kinetik, yang bisa membuat proses ini sangat bervariasi dan sulit dikontrol. Faktor-faktor seperti tingkat ketidakmurnian, metode penyamburan, desain wadah, dan profil pendinginan bisa berpengaruh besar terhadap ukuran, jumlah dan bentuk kristal yang dihasilkan.
Ambil sebagai contoh sebuah molekul yang terletak di dalam kristal yang murni dan sempurna, yang kemudian dipanasi dari luar. Pada titik suhu tertentu, melukul ini mendadak harus keluar dari posisinya, dan struktur komplex yang terbentuk sekitar molekul ini ambruk jadinya. Menurut buku termodinamika, sebuah bahan adalah meleleh jika peningkatan entropi, S, pada sebuah sistem melalui pengacakan molekul-molekul di dalam ruang (spatial randomization of the molecules) lebih besar nilainya dari entalpi, H, disebabkan oleh pecahnya gaya-gaya dari kemasan kristal.
Hal ini terjadi jika suhu jalan meningkat. Dengan dasar yang sama, kalau suhu campuran leleh diturunkan, sebuah molekul akan duduk kembali dalam posisi struktur kristal. Tingkat Entropi berkurang karena naiknya tingkat keteraturan molekul-molekul di dalam ruang sistem dikompensasi jauh lebih tinggi oleh panas dari pengacakan daerah luar sekitar ruang, karena dibebaskannya panas fusi; yang berarti entropi semesta naik nilainya.
Tetapi cairan-cairan yang didinginkan dan bertingkah seperti di atas merupakan kekecualian dan bukan hal umum, kendati hukum termodinamika kedua, kristalisasi biasanya terjadi pada suhu yang lebih rendah (supercooling). Ini hanya bisa berarti bahwa sebuah kristal lebih mudah dirusak daripada dibentuk. Dan ini juga berarti, biasanya lebih mudah melarutkan sebuah kristal sempurna di dalam pelarut daripada membentuk sebuah kristal sempurna kembali dari larutan itu.
Selanjutnya, nukleasi (pembentukan butiran inti) dan pertumbuhan sebuah kristal terjadi di bawah pengaruh kinetik, dan bukan termodinamik.
Daftar pustaka
- Glynn P.D. and Reardon E.J. (1990) "Solid-solution aqueous-solution equilibria: thermodynamic theory and representation". Amer. J. Sci. 290, 164-201.
- Geankoplis, C.J. (2003) "Transport Processes and Separation Process Principles". 4th Ed. Prentice-Hall Inc.
- Stanley SJ. (2006) Tomographic imaging during reactive precipitation: mixing with chemical reaction, Chemical Engineering Science, 61 (23), pp 7850–7863
- Nocent M, Bertocchi L, Espitalier F. & al. (2001) "Definition of a solvent system for spherical crystallization of salbutamol sulfate by quasi-emulsion solvent diffusion (QESD) method", Journal of Pharmaceutical Sciences, 90, 10, 1620-1627.
Proses
- Solvent recrystallisation
-
 Proses
Proses -
 Filtrasi panas, 1 pelarut
Filtrasi panas, 1 pelarut -
 2 pelarut
2 pelarut -
 2 pelarut, dengan evaporasi
2 pelarut, dengan evaporasi
- X-ray crystals
-
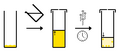 Evaporasi lambat, 1 pelarut
Evaporasi lambat, 1 pelarut -
 Evaporasi lambat, 2 pelarut
Evaporasi lambat, 2 pelarut -
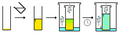 Difusi gas lambat, 2 pelarut
Difusi gas lambat, 2 pelarut -
 Difusi cair lambat
Difusi cair lambat -
 Difusi cair lambat - H Tube
Difusi cair lambat - H Tube
Pranala luar
- Industrial Crystallization



















