Schwefelmonoxid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
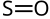 | ||||||||||
| Allgemeines | ||||||||||
| Name | Schwefelmonoxid | |||||||||
| Andere Namen | Schwefel(II)-oxid | |||||||||
| Summenformel | SO | |||||||||
| Kurzbeschreibung | farbloses Gas[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 48,06 g·mol−1 | |||||||||
| Aggregatzustand | gasförmig | |||||||||
| Dipolmoment | 1,55(2) D[2] (5,2 · 10−30 C · m) | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 | 6,3 kJ/mol[4] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Schwefelmonoxid ist eine anorganische chemische Verbindung des Schwefels aus der Gruppe der Oxide.
Gewinnung und Darstellung
Schwefelmonoxid kann durch Reaktion von Schwefel mit Schwefeldioxid in einer elektrischen Entladung gewonnen werden.[5]
Ebenfalls möglich ist die Darstellung durch Verbrennen von Schwefel in reinem Sauerstoff bei vermindertem Druck.[5]
Eigenschaften
Schwefelmonoxid ist ein farbloses, unbeständiges Gas. Es ist nur bei geringen Drücken (< 1 mbar) beständig. Bei höheren Drücken bzw. beim Kondensieren mit flüssiger Luft entstehen orangerote bis kirschrote plastische Produkte, die beim Erwärmen unter Schwefeldioxid-Abspaltung zu gelben Polyschwefeloxiden disproportionieren.[5][1]
Schwefelmonoxid ist ein hochreaktives Molekül, das wie Sauerstoff in einem Triplett-Grundzustand vorliegt.[6]
Einzelnachweise
- ↑ a b Wilhelm Klemm, Rudolf Hoppe: Anorganische Chemie. Walter de Gruyter, 1980, ISBN 3-11-007950-X, S. 111 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-52.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-16.
- ↑ a b c Egon Wiberg: Lehrbuch der Anorganischen Chemie: Mit einem Anhang: Chemiegeschichte. Walter de Gruyter, 1960, ISBN 3-11-023832-2, S. 201 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ralf Steudel: Chemie der Nichtmetalle: Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 3-11-021128-9, S. 117 (eingeschränkte Vorschau in der Google-Buchsuche).












